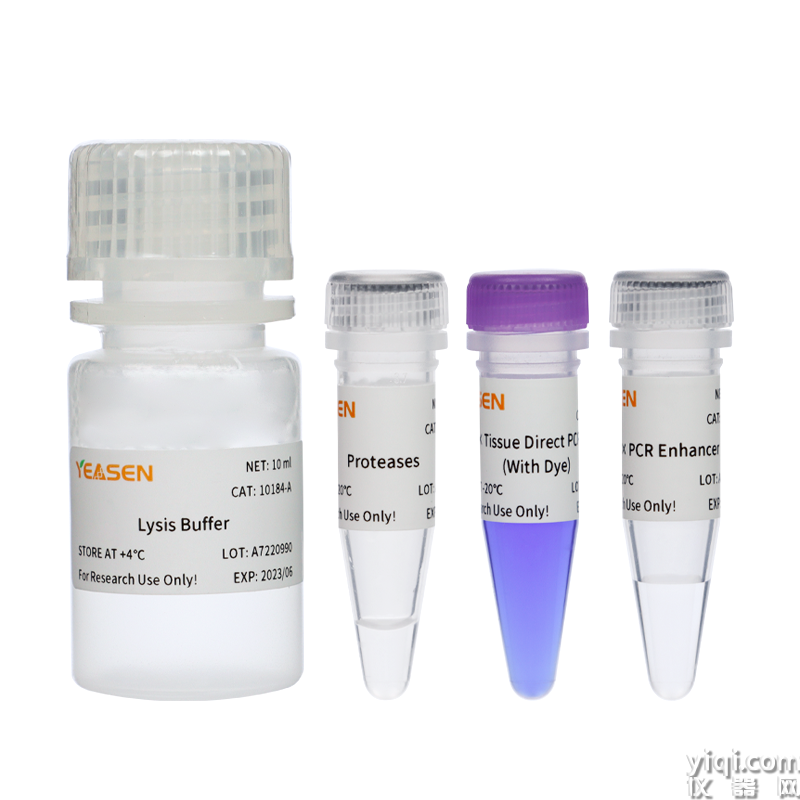
 Animal Tissue Direct PCR Kit (With Dye) 動物組織直接PCR試劑盒
Animal Tissue Direct PCR Kit (With Dye) 動物組織直接PCR試劑盒
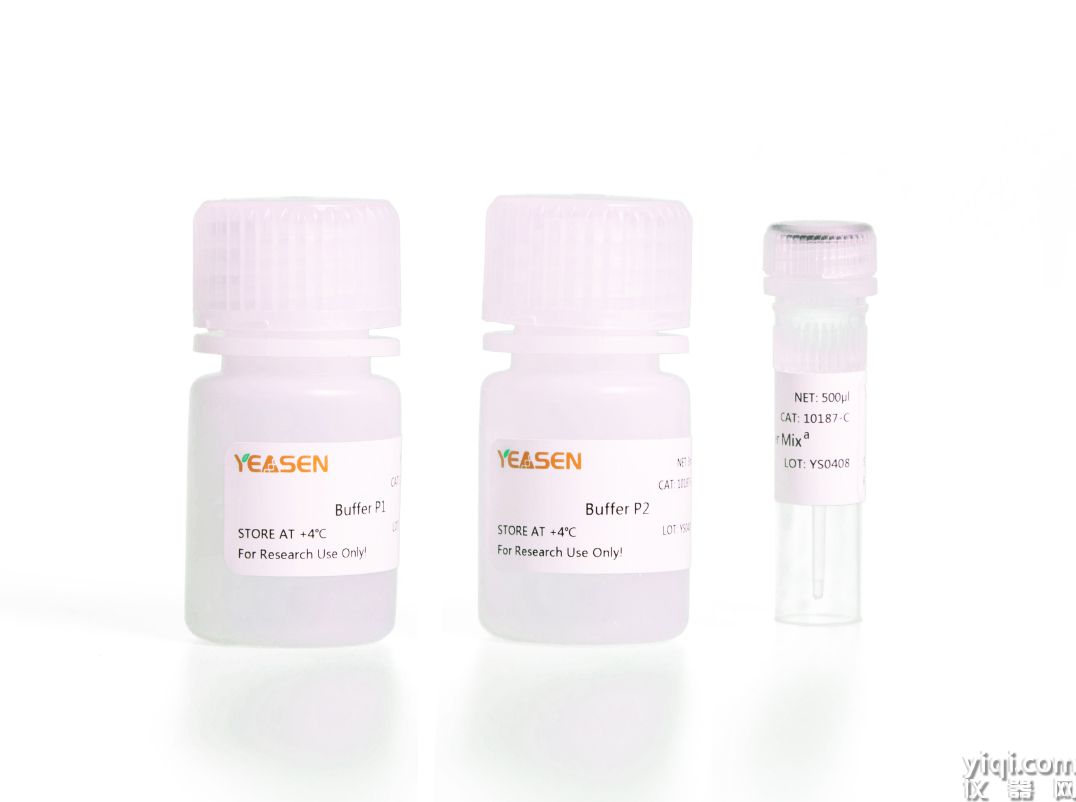 植物組織直接PCR試劑盒Plant Tissue PCR Kit (With Dye)
植物組織直接PCR試劑盒Plant Tissue PCR Kit (With Dye)
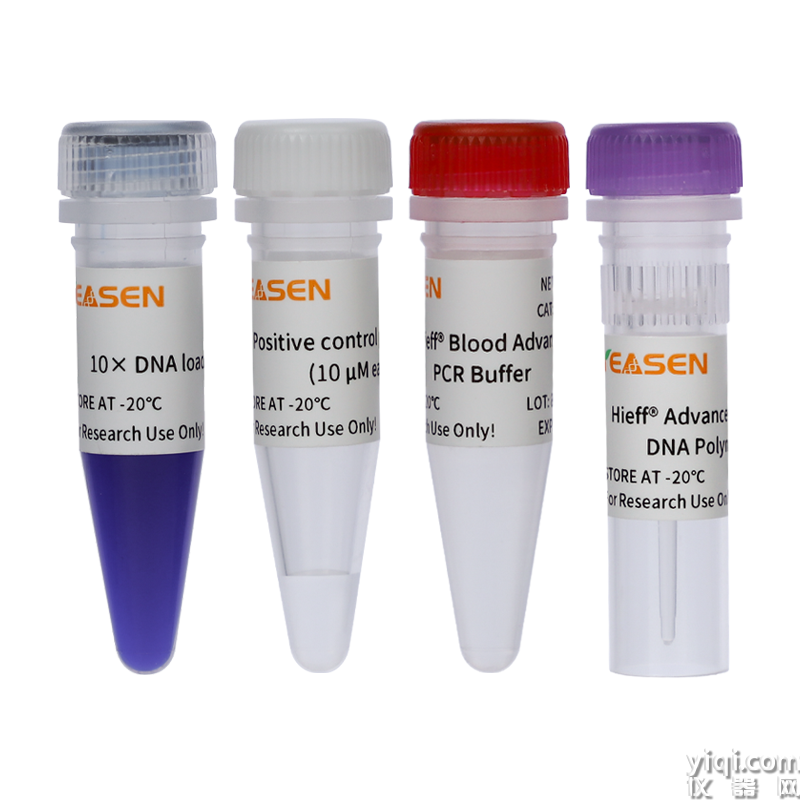 血液直接PCR試劑盒Blood Advanced Direct PCR Kit
血液直接PCR試劑盒Blood Advanced Direct PCR Kit
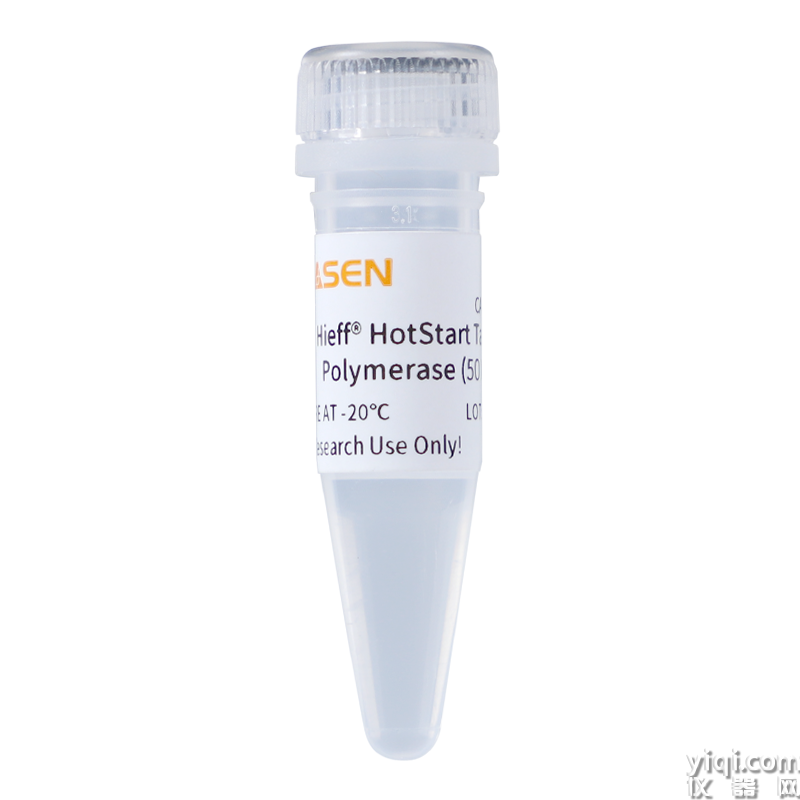 Hieff<sup>?</sup> HotStart Taq DNA Polymerase,50 U/μL
Hieff<sup>?</sup> HotStart Taq DNA Polymerase,50 U/μL
 Hieff UNICON<sup>?</sup> HotStart Taq DNA Polymerase,50 U/μL
Hieff UNICON<sup>?</sup> HotStart Taq DNA Polymerase,50 U/μL
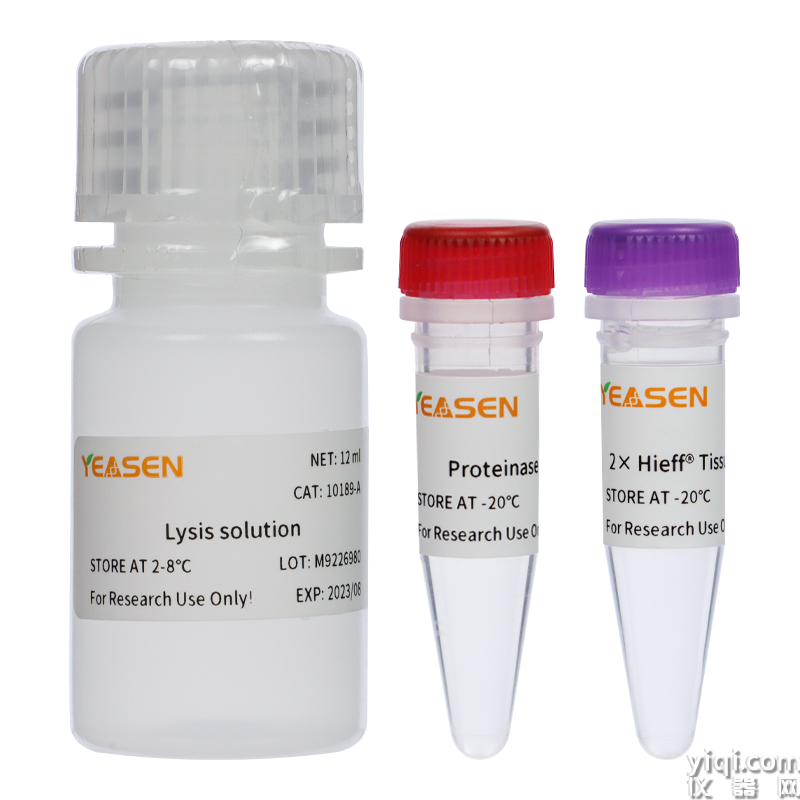
本試劑盒可直接快速地對小鼠組織(如鼠尾、鼠耳、鼠趾等)樣本進行PCR擴增,具有極強的樣本兼容性。本試劑盒配備了強力的裂解緩沖液,可以快速裂解樣品,釋放基因組DNA。裂解產物可以直接加入到PCR反應體系中,無需精提純化,操作方便。此外,本試劑盒對樣品投入量要求低,2-5 mm2鼠耳或肝臟、1-5 mm鼠尾、1-2個腳趾均可進行實驗。
本試劑盒提供的2× Hieff® Tissue Direct PCR Mix為2倍濃度的熱啟動PCR反應液,包含了用于PCR擴增除模板和引物外的所有組分,大大簡化操作過程,降低污染幾率。
該試劑盒可用于轉基因鑒定、小鼠基因分型等。
產品組分
|
編號 |
組分 |
產品編號/規(guī)格 |
|||
|
10189ES20 (20 T) |
10189ES50 (50 T) |
10189ES70 (200 T) |
10189ES76 (500 T) |
||
|
10189-A |
Lysis solution a |
5 mL |
12 mL |
4× 12 mL |
10× 12 mL |
|
10189-B |
Proteinase K (20 mg/ml) |
250 μL |
625 μL |
2× 1.25 mL |
5× 1.25 mL |
|
10189-C |
2× Hieff® Tissue Direct PCR Mix b |
500 μL |
1.25 mL |
5× 1 mL |
10× 1.25 mL |
a) Lysis solution為裂解液,請戴手套操作。
b) 2× Hieff® Tissue Direct PCR Mix:包含熱啟動Taq DNA聚合酶、dNTP混合物、4 mM Mg2+、PCR反應增強劑、穩(wěn)定劑等。
運輸方法
干冰運輸。
保存方法
1. 組分A:2-8℃保存,有效期1年。若長時間多次使用,請分裝后儲存,避免交叉污染。
2. 組分B/C:-20℃保存,避免反復凍融。有效期1年。
操作方法
樣品基因組DNA釋放
1. 剪取2-5 mm2鼠耳或肝臟組織,或1-5 mm鼠尾、或1-2個腳趾,置于1.5 mL離心管中;
2. 在上述離心管中加入200 μL Lysis solution和10 μL Proteinase K,輕輕渦旋混勻,使得樣品完全被浸潤,短暫離心;
3. 在恒溫孵育儀中70℃孵育10 min;
4. 孵育完成后,將樣品置于95℃或者沸水浴中加熱5 min滅活Proteinase K;
5. 將裂解產物渦旋振蕩充分混勻后,12000 rpm (13400× g)離心10 min;
6. 將上清轉移至新的離心管,-20℃保存不超過48小時或直接取上清用于后續(xù)PCR擴增。
【注】:1. 組織應盡量剪碎,以便裂解反應更順利進行。
2. 70℃孵育,一般10 min即可滿足多數PCR需求。若需要的DNA量較大或樣品較難裂解,可將時間延長至20-30 min。組織塊不需完全裂解,殘余的部分在后續(xù)離心步驟中可被除去。
PCR反應體系
|
組分 |
體積(μL) |
終濃度 |
|
2× Hieff® Tissue Direct PCR Mix |
25 |
1× |
|
Forward Primer (10 μM) |
2 |
0.4 μM |
|
Reverse Primer (10 μM) |
2 |
0.4 μM |
|
裂解產物 |
1-5 |
- |
|
ddH2O |
補足至 50 μL |
- |
【注】:各組分使用前應充分混勻。
a) 模板使用量:50 μL體系建議初步采用2 μL上清液作為模板起始投入量,若產物量較少,可適當增加模板投入量;
b) 引物終濃度:0.2-0.4 μM可以得到較好結果。反應性能較差時,可在0.1-0.5 μM范圍內調整引物濃度;
c) 反應體系:推薦使用50 μL,也可根據使用習慣調整體系體積大小;
d) 體系配制:配制好PCR反應體系,置于渦旋儀上渦旋混勻,瞬時離心將反應液集于管底。
PCR反應程序
|
循環(huán)步驟 |
溫度 |
時間 |
循環(huán)數 |
|
預變性 |
95℃ |
5 min |
1 |
|
變性 |
95℃ |
15 sec |
35 |
|
退火 |
60℃ |
15 sec |
|
|
延伸 |
72℃ |
3-10 sec/kb |
|
|
終延伸 |
72℃ |
5 min |
1 |
【注】:a) 退火溫度:請參考引物的理論Tm值,退火溫度可設置低于引物理論值 2-5℃。
b) 延伸時間:1-4 kb用3-10 s/kb,4 kb以上用20 s/kb。
c) 擴增循環(huán)數:35個循環(huán)已可以擴增足量產物。
d) 電泳上樣:取5-7 μL擴增產物上樣即可。
對照反應
在PCR結果分析時,不管是陽性結果或陰性結果,如果沒有對照反應,都不能確定結果是否可靠。為了便于后續(xù)實驗結果的分析,建議在進行PCR時,設置陽性(小鼠基因組DNA)和陰性(通常為生理鹽水)PCR對照反應以便于排除假陽性或假陰性的干擾。
注意事項
1. 為了避免樣本間交叉污染,每次取樣后都需要將取樣器材的刃口或與樣本直接接觸的部位浸入2%次氯酸鈉溶液或75%酒精中,反復洗刷數次進行清洗,然后用干凈的紙巾擦干殘余液體后再進行使用。為了試驗方便,也可準備多個取樣器材,在使用完后進行統(tǒng)一清洗,確保每一單獨樣本均使用的是無污染的取樣器材。
2. 建議使用新鮮采取的動物組織,若為長期冷凍組織,應盡量避免反復凍融,否則會導致模板的降解,影響PCR效率。
3. 建議擴增片段長度6 kb以內,以便擴增效率最佳。
4. 為了您的安全和健康,請穿實驗服并佩戴一次性手套操作。
5. 本產品僅作科研用途!
常見問題與解決方法
|
常見問題 |
可能原因 |
解決方法 |
|
陽性對照、待測樣本均無條帶。 |
PCR反應體系或反應條件不合適。 |
使用梯度PCR摸索PCR最佳反應條件。 |
|
PCR試劑保存不當失去活性。 |
2× Mouse Direct PCR Mix應保存于-20℃,使用時避免反復凍融。若使用頻繁,可在4℃短時間存放。 |
|
|
引物設計問題。 |
嘗試重新設計引物進行檢查。 |
|
|
陽性對照有目的條帶,待測樣本無條帶或條帶弱。 |
不當儲存或長期儲存引起試劑活性喪失。 |
使用新鮮的試劑。 |
|
加入組織裂解液過量。 |
增大反應體系,或減少裂解液的用量。 |
|
|
樣本裂解混合液保存不當或保存時間過久,DNA基因組已經降解。 |
裂解混合液液可在4℃保存2-3天,盡量使用新制備的裂解液混合液進行PCR。 |
|
|
模板加入量不適合。 |
在反應體系1-10%范圍內優(yōu)化模板加入量。 |
|
|
PCR循環(huán)數不足。 |
增加PCR的循環(huán)數,推薦在35-40循環(huán)為佳。因為模板復雜,PCR反應要比用純化的DNA模板多5-10個循環(huán)為佳。 |
|
|
非特異性擴增 |
PCR退火溫度太低,循環(huán)數、引物濃度或模板濃度太高。 |
增加PCR退火溫度,降低PCR循環(huán)數、引物濃度或模板濃度。 |
|
PCR引物錯配。 |
重新設計PCR引物。 |
|
|
配制PCR反應體系時溫度太高或配制完成后放置時間太久。 |
PCR反應體系的配制在低溫下進行,配制完成后盡快進行PCR擴增反應。 |
|
|
陰性對照出現目的條帶 |
操作工具或試劑污染。 |
實驗所有試劑或器材均應高壓滅菌。操作時應小心輕柔,防止將靶序列吸入加樣槍內或濺出離心管外。 |
|
樣本間交叉污染。 |
每個取樣器只對一個樣本使用;或取完一個樣本后,將取樣器刃口浸入2%的次氯酸鈉溶液中,反復涮洗,然后用干凈的紙巾擦干殘液。 |
HB220926
報價:面議
已咨詢18次分子生物學

報價:面議
已咨詢25次分子生物學

報價:面議
已咨詢24次分子生物學

報價:面議
已咨詢31次分子生物學

報價:面議
已咨詢146次分子生物學
報價:面議
已咨詢659次PCR單管

報價:面議
已咨詢603次PCR八聯管

報價:¥1
已咨詢1038次PCR孔板